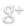Para realizar la estructura de Lewis del H2O2 (Peróxido de Hidrógeno) vamos a seguir unos sencillos pasos.
Empezaremos por dibujar la estructura general de la molécula del peróxido de hidrógeno uniendo los átomos con enlaces simples:
Ahora contaremos los electrones de valencia totales de los átomos de Oxigeno (n O,val = 6) e hidrógeno (n H,val = 1), donde “n” sería la cantidad de átomos de dicho elemento que posee la molécula:
2 O Valencia + 2 H Valencia = 2 x 6 + 2 x 1 = 14
Luego tenemos que calcular el número de electrones necesarios para llenar completamente las capas de valencia tanto para el oxígeno como para el hidrógeno.
El Oxígeno para completar su capa de valencia y por lo tanto, cumplir con la regla del octeto, necesita 8 electrones en su último orbital. Pero, como son dos átomos de oxígeno, multiplicaremos estos 8 electrones por dos.
Por otra parte, el hidrógeno para cumplir con la regla del octeto necesita 2 electrones en el último orbital, pero tenemos dos atomos de hidrogeno, por lo tanto, multiplicaremos estos 2 electrones por dos..
Ahora realizamos la suma:
2 O última capa + 2 H última capa = 2 x 8 + 2 x 2 = 20
El siguiente paso será restar los dos resultados que obtuvimos y así obtener el número de electrones enlazantes.
20 – 14 = 6 electrones enlazantes (tres enlaces).
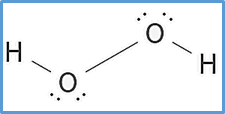
Cada enlace tiene dos electrones, por lo que el diagrama de lewis del H2O2 anterior tiene todos los enlaces necesarios.
Por último, se debe completar la estructura con los electrones no enlazantes que quedan en cada átomo.
En total quedan 14 – 6 = 8 electrones sin enlazar, estos serán lo que agregaremos a los átomos.