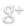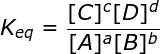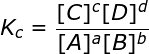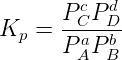La constante de equilibrio es una expresión matemática que nos permite conocer hacia dónde se desplaza el equilibrio de una determinada reacción.
Para una reacción del tipo: aA + bB ↔ cC + dD los quimicos Guldberg y Waage expresaron que la velocidad de la reacción es directamente proporcional a la concentración de reactivos o productos v ∝ [ Reactivo o Producto].
Escribimos la ecuación para la velocidad de la reacción directa:
Realizamos lo mismo para la velocidad de reacción inversa:
Nosotros sabemos que en el equilibrio químico las velocidades de reacción directa e inversa son iguales, entonces escribimos e igualamos:
Pasamos la constante k al primer miembro, y las concentraciones de A y B al segundo miembro:
El resultado de dividir una constante entre otra constante, es una constante. Nosotros la llamaremos Constante de equilibrio o Kc. Finalmente obtenemos la siguiente expresion:
Los coeficientes estequiometricos a, b, c, y d, aparecen como potencias de las concentraciones de reactivos y productos.
La constante de equilibrio Keq toma para cada reacción, un valor constante y característico que solo depende de la temperatura.
Se puede expresar la constante en términos de concentración:
Solo participan en esta relación de concentraciones, compuestos que se encuentren en estado gaseoso o en solución. Los solidos y liquidos puros, como el agua líquida, no se los incluye debido a que su concentracion permanece constante.
Si Kc > 1 la reacción química esta desplazada hacia los productos (reaccion directa), por lo tanto habrá mayor formación de productos.
Si Kc < 1 la reacción química esta desplazada hacia los reactivos (reacción inversa), por lo tanto habrá mayor formación de reactivos.
Esta es la expresión matemática que define la constante de equilibrio para todas las reacciones donde se establece el equilibrio, La ley de Guldberg y Waage se conoce también como Ley de acción de masas. Esta ley fue el resultado de análisis de datos experimentales y se enuncia de la siguiente manera:
“En un sistema en equilibrio, el cociente del producto de las concentraciones (mol/L) de las sustancias resultantes, entre el producto de las sustancias reaccionantes, cada una de ellas elevada a una potencia igual al número de moles que intervienen en la reacción, es un valor constante para cada temperatura”.
También se puede expresar la constante en términos de la presiones parciales de los productos y reactivos, se denomina Kp. La unidad de presión que se emplea es atmósfera (atm):
RELACION ENTRE Kp y Kc
Δn = n° de moles gaseosos de los productos – n° de moles gaseosos de lo reactivos.
R = constante de los gases
T = temperatura absoluta