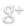El principio de Le Chatelier afirma que si el equilibrio químico se ve alterado por el cambio de la presión, concentración o temperatura, la posición del equilibrio se desplaza para contrarrestar el cambio y restablecer el equilibrio. Si una reacción química está en equilibrio y experimenta un cambio en la presión, temperatura o concentración, el equilibrio se desplaza en la dirección opuesta para compensar el cambio.
Introducción
Una acción que cambia la temperatura, presión o concentración de las especies químicas en un sistema en equilibrio estimula una respuesta que compensa parcialmente el cambio mientras se establece una nueva condición de equilibrio. Por lo tanto, el principio de Le Chatelier establece que si se produce un cambio de presión, temperatura o concentración el equilibrio se ajustará para compensar ese cambio. Le Chatelier propuso uno de los conceptos centrales del equilibrio químico, que describe lo que le sucede a un sistema cuando algo lo quita brevemente de un estado de equilibrio.
CAMBIOS EN LA CONCENTRACIÓN
El principio de Le Chatelier establece que si se aumenta la concentración de una de las especies reaccionantes, el equilibrio se desplazará hacia la reaccion que tiende a consumir dicha especie. En otras palabras, si hay un aumento en los productos, el cociente de reacción, QC , se incrementa, haciéndolo mayor que la constante de equilibrio, KC . Teniendo en cuenta la siguiente reacción:
A + 2B ⇌ C + D
Aumento de la concentración
¿Qué sucede si aumentamos la concentracion de A?
Según Le Chatelier, la posición de equilibrio se moverá para contrarrestar el cambio. En este caso, la posición de equilibrio se moverá para que la concentración de A disminuya y de esta manera formar más C y D. El equilibrio se mueve hacia la derecha (Reacción directa).
Disminución de una concentración
En el caso opuesto, en el que la concentración de A disminuye, según Le Chatelier, la posición de equilibrio se moverá para que la concentración de A vuelva a aumentar. Las concentraciones de C y D disminuyen para reemplazar el A que ha sido removido. El equilibrio se mueve hacia la izquierda (Reacción inversa).
CAMBIOS DE PRESIÓN
Esto sólo se aplica a las reacciones que involucran gases, aunque no necesariamente todas las especies en la reacción necesitan estar en la fase gaseosa. A continuación se da una reacción gaseosa homogénea general:
A(g) + 2B(g) ⇌ C(g) + D(g)
Aumento de la presión
Según Le Chatelier, si la presión aumenta, la posición de equilibrio se moverá para que la presión se reduzca de nuevo. La presión es causada por moléculas de gas que golpean la superficie del recipiente. Cuantas más moléculas haya en el recipiente, mayor será la presión.
En este caso, hay tres moles en el lado izquierdo de la ecuación, pero sólo dos en el lado derecho. Un aumento de la presión hace que el equilibrio se desplaze en el sentido donde haya menor número de moles (menor volumen de moléculas gaseosas), por lo tanto se desplazará el equilibrio hacia la derecha (reacción directa).
Disminución la presión
Al disminuir la presión el equilibrio químico se desplaza hacia donde haya menor número de moles (menor volumen de moléculas gaseosas). En este caso, el equilibrio se moverá hacia el lado izquierdo (reaccion inversa).
¿Qué sucede si hay el mismo número de moles en ambos lados de la reacción?
En este caso, el aumento o disminución de la presión no tiene ningún efecto sobre la posición del equilibrio. Debido a que hay un número igual de moles (igual volumen) en ambos lados, el equilibrio no puede moverse de ninguna manera para que se reduzca la presión de nuevo.
CAMBIOS DE TEMPERATURA
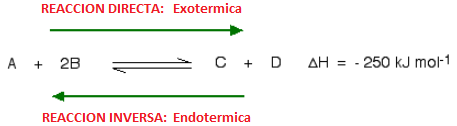
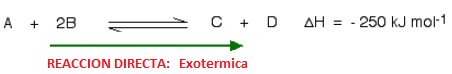
Para entender cómo los cambios de temperatura afectan las condiciones de equilibrio, el signo de la entalpía de reacción debe ser conocido. Supongamos que la reacción directa es exotérmica (desprende energía):
En esta reacción, 250 kJ se desprenden (signo negativo) cuando 1 mol de A reacciona completamente con 2 moles de B. Para reacciones reversibles, el valor de entalpía siempre se da como si la reacción ocurriera en el sentido directo (en el caso anterior la reacción directa es exotérmica). La reacción inversa (la conversión de C y D en A y B) sería endotérmica, absorbiendo la misma cantidad de calor.
MUY IMPORTANTE: La temperatura altera el valor de la constante de equilibrio.
Aumento de la temperatura
Si la temperatura aumenta, entonces la posición de equilibrio se moverá para que la temperatura se reduzca de nuevo. Supongamos que el sistema está en equilibrio a 300°C y la temperatura aumenta 500°C. Para enfriarse, necesita absorber el calor extra añadido. En este caso, la reacción inversa es aquella en la que se absorbe el calor (reacción endotérmica). La posición de equilibrio se mueve a la izquierda. En otras palabras, un aumento de la temperatura favorece la reacción endotérmica (que absorbe calor).
Disminución de la temperatura
El equilibrio se moverá de tal manera que la temperatura vuelva a aumentar. Supongamos que el sistema está en equilibrio a 500°C y la temperatura se reduce a 400°C. La reacción tenderá a calentarse de nuevo para volver a la temperatura original favoreciendo la reacción exotérmica. La posición de equilibrio se moverá hacia la derecha, ya que al disminuir la temperatura el equilibrio se ve favorecida la reacción exotérmica (desprende calor).
Resumen de los efectos de la temperatura
Aumentar la temperatura de un sistema en equilibrio favorece la reacción endotérmica. El sistema contrarresta el cambio absorbiendo el calor adicional.
Disminuir la temperatura de un sistema en equilibrio favorece la reacción exotérmica. El sistema contrarresta el cambio produciendo más calor.
El Principio de Le Chatelier y los Catalizadores
Añadir un catalizador a la reacción química no tiene ningún efecto sobre el equilibrio, y el principio de Le Chatelier no se aplica. Esto se debe a que un catalizador acelera la reacción directa y la reacción inversa en la misma medida y la adición de un catalizador no puede afectar el equilibrio químico.
Sin embargo, los catalizadores tienen una aplicacion muy util para sistemas en equilibrio. Para llegar a un equilibrio las velocidades de la reacción directa e inversa deben ser iguales, pero en reacciones lentas esto no ocurre inmediatamente. Pero gracias al catalizador se puede alcanzar el equilibrio con mayor rapidez, incluso para reacciones lentas.