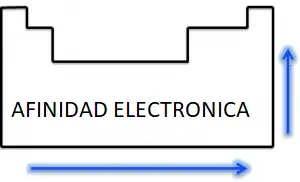
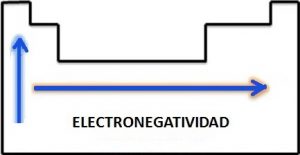
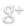La Afinidad Electrónica o la Electroafinidad (A)
La afinidad electrónica es la energía absorbida cuando un átomo en estado gaseoso acepta un electrón.
X(g) + e– ⇒ X–(g)
Este proceso es exotérmico, por lo tanto es una magnitud negativa ΔH < 0 . Difícilmente puede establecerse generalidades en un grupo o periodo de la tabla acerca de la Afinidad electrónica, pero podría decirse que dentro de un periodo de la tabla la afinidad electrónica aumenta con el número atómico; y dentro de un grupo disminuye con el número atómico, debido al efecto de pantalla. (nota: en los libros la afinidad electrónica suele figurar como electroafinidad)
Al: -42,5 Kj/mol Si: -133,6 Kj/mol S: -200 Kj/mol Cl:-348 Kj/mol
Electronegatividad (X)
Mide la capacidad relativo del átomo a atraer los electrones cuando se combinan químicamente con otros átomos.
Mulliken define la electronegatividad como el promedio entre la energía de ionización y la electroafinidad:
X = (I + A) / 2
Alfred y Rochow definieron la electronegatividad como la fuerza ejercida por el átomo sobre los electrones, y la expresaron como:
XAB = 3590 Z/r + 0,744
Donde Z es la carga nuclear efectiva y r es el radio covalente del átomo en pm (picometro).
En un periodo de la tabla periódica: La electronegatividad aumenta con el numero atómico.
En un grupo de la tabla periódica: La electronegatividad disminuye al aumentar el numero atómico.
| La energía de ionización y la electroafinidad son cantidades medibles experimentalmente; la electronegatividad es un valor RELATIVO y no puede medirse. Los valores de la electronegatividad que figuran en las tablas pueden ser a veces diferentes, según la ecuación utilizada para el calculo. Según Pauling, los valores de la electronegatividad van desde 0,7 hasta 4. |
Es sumamente necesario comprender lo básico de la energía de ionización, afinidad electrónica y electronegatividad para adentrarnos mas en el tema de enlace químico.