Ley de Dalton de las Presiones Parciales

Ley de Dalton de las presiones parciales
¿Qué dice la ley de las presiones parciales?
La Ley de Dalton de las presiones parciales dice que la presión total de una mezcla de gases es igual a la suma de las presiones parciales que cada gas ejerce de manera independiente ocupando todo el volumen disponible del recipiente.
¿Qué es la presión parcial de un gas?
La presión parcial de un gas es la presión que ejerce un solo gas dentro de una mezcla de gases. Es menor que la presión total. La fórmula de la presión parcial es Pi = X1 . PT donde Pi es la presión parcial, X1 es la fracción molar de dicho gas, P es la presión total de la mezcla.
¿Qué dice la ley de Dalton sobre los gases?
Si lo gases presentes en la mezcla de un gas se encuentran en las mismas condiciones de temperatura y volumen, la presión total de la mezcla de los gases es igual a las sumatoria de las presiones parciales de cada gas. De acuerdo a la ecuación: PT = P1 + P2 +....+ Pn
Deducción de las ecuaciones
Para entender de dónde vienen las ecuaciones de la Ley de Dalton. Supongamos que tenemos dos gases A y B. Donde la presión para cada uno de estos gases de manera independiente a temperatura y volumen constante es:
Presión del gas A PA = (nA RT) / V
Presión del gas B PB = (nB RT) / V
Luego se procede a sumar estas presiones para obtener la siguiente ecuación:
Bien, ahora si nos fijamos bien la temperatura, y el volumen son valores constantes. Por lo tanto se puede sacar factor común para obtener:
Si aplicamos una relación entre la presión parcial de un gas con la presión total, simplificando los términos constantes obtenemos la famosa ecuación:
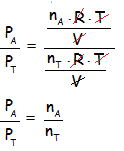
La división entre los moles de A y los moles Totales, se llama fracción molar y se denota con la letra X. Pasamos la presión total que se encuentra dividiendo al segundo miembro. Finalmente queda la ecuación deducida de la Ley de Dalton:
![]() Para el gas B también tendría su ecuación de igual manera:
Para el gas B también tendría su ecuación de igual manera:
![]() Que nos dice esta ecuación? Que la presión parcial de un gas es directamente proporcional a su fracción molar.
Que nos dice esta ecuación? Que la presión parcial de un gas es directamente proporcional a su fracción molar.
Biografia de John Dalton
John Dalton nació el 6 de septiembre de 1766 en Eaglesfield Gran Bretaña. Fue un científico y químico que realizó grandes contribuciones al mundo de la ciencia y la Química, donde la una de las más importantes relacionada a la teoría atómica de la materia que hoy en día consideramos pilares de la ciencia contemporánea como el modelo de Dalton. 
Pese a su lamentable situación económica su padre lo envió a una escuela religiosa de Inglaterra. Tiempo después Dalton conoció a su futuro maestro Pardshow Hall quien le daría a Dalton las bases y condiciones para alcanzar nuevos conocimientos.
Tiempo más tarde, Robinson se convertiría en el consejero de Dalton. Este lo impulsó a estudiar matemáticas y ciencias con un centro de atención hacia la meteorología que en aquel entonces no se sabía lo suficiente.
Dalton decidió abrir una escuela con tan solo 12 años. Pero tuvo que cerrarla por diversos problemas económicos, volvió a centrarse en trabajos de campo.
Trabajo como asistente del maestro Bewley en una escuela de Kendall. Cuando este maestro dejó de ejercer su profesión, Dalton volvió a una nueva escuela.
A finales del siglo XVIII, John Dalton conoció a John Gough a fines de 1790. El señor Gough era una persona rica, inculcó a Dalton dandole clases de óptica, y matemáticas. Además le ofreció su biblioteca para que Dalton estudie de manera autodidacta.
Con el tiempo Dalton se volvió experto en algunos temas como geografía,astronomía, biología y ganaba algo de dinero realizando conferencias.
Más adelante se dio cuenta que tenía ciertos problemas a la hora de diferenciar colores. Desde entonces se puso a investigar sobre la percepción del color, de la cual publicaría un ejemplar llamado Hechos relativos a la visión de los colores.
Aportaciones de Dalton a la Ciencia
Teoría atómica de Dalton
La teoria de John Dalton dice que la materia está compuesta por átomos que poseen diferentes masas y se combinan en proporciones sencillas para formar compuestos. Cualquier forma de materia está formada por partículas pequeñas e indivisibles a las que llamó átomos (basándose en lo que decía el filósofo Demócrito).
¿Cuáles son los postulados de Dalton?
- La materia está formada por partículas pequeñas, indivisibles e inalterables llamadas átomos.
- Los átomos de un mismo elemento son iguales en peso, propiedades fisicas y quimicas.
- En las reacciones químicas, los átomos ni se crean ni se destruyen, solo cambian su distribución.
- Los compuestos están formados por moléculas.
- Los compuestos químicos están formados por moléculas, todos iguales entre sí. Es decir, cuando dos o más átomos de diferentes elementos se combinan para formar un mismo compuesto lo hacen siempre en proporciones de masa definidas y constantes.
Ley de las proporciones multiples
Enunciada por John Dalton, en el año 1803, es una importante ley estequiométrica. Establece que los pesos de los elementos se combinan entre sí en más de una proporción con una cantidad fija formando compuestos distintos. Un elemento de cantidad fija se combina con otro elemento en mas de una proporción formando compuestos distintos.
Por ejemplo, el cobre y el oxígeno se combinan y pueden formar dos óxidos de cobre diferentes: el CuO (óxido cúprico) y el Cu2O (Oxido Cuproso).
Para el CuO 3,914 gramos de cobre se combinan con un gramo de oxígeno.
Para el Cu2O 7,945 gramos de cobre se unen a cada gramo de oxígeno.
Si hacemos la relación (division) 7,935 / 3,963 obtenemos un número entero sencillo igual a 2, tal como predijo Dalton en su teoria.
Recomendación: Ley de Boyle
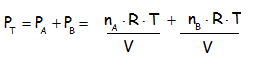
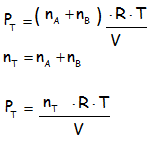
Deja una respuesta