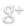Si queremos realizar la estructura de Lewis del CCl4 (Tetracloruro de Carbono) seguiremos lo siguientes pasos.
Comience por dibujar la estructura general de la molécula del CCl4 uniendo los átomos de cloro con el carbono con enlaces simples:
Ahora contaremos los electrones de valencia totales de los átomos de cloro (n Cl,val = 7) y carbono (n C,val = 4), donde “n” serían la cantidad de átomos del elemento. Sumamos:
4 Cl Valencia + C Valencia = 4 x 7 + 4 = 32
Luego tenemos que calcular el número de electrones necesarios para llenar completamente las capas de valencia para el cloro y el carbono.
El cloro para completar su capa de valencia y por lo tanto, cumplir con la regla del octeto, necesita 8 electrones en su último orbital. Pero, como son cuatro átomos de cloro, multiplicaremos estos ocho electrones por cuatro.
Por otra parte, el carbono para cumplir con la regla del octeto necesita 8 electrones en el último orbital.
Ahora realizamos la suma:
4 Cl última capa + C última capa = 4 x 8 + 8 = 40
El siguiente paso será restar los dos resultados que obtuvimos y así obtener el número de electrones enlazantes.
40 – 32 = 8 electrones enlazantes (4 enlaces).
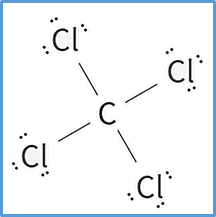
Ahora si nos fijamos en el diagrama de lewis del Ácido Sulfhídrico, veremos que ya tenemos esos 8 electrones distribuidos en cuatro enlaces (ya que cada enlace posee dos electrones), por lo tanto, ya tiene todos los enlaces necesarios.
Hay 4 enlaces, lo que corresponde a 8 electrones enlazantes en el diagrama.
En total, quedan 32 – 8= 24 electrones no enlazantes.
Por último, rellene los electrones no enlazantes que quedan en los átomos de cloro (solo agregaremos los necesarios para cumplir con la regla del octeto).
De esta manera obtendremos finalmente la Estructura de CCl4 (Tetracloruro de Carbono).